隨著第三批醫療器械產品實施工作的開啟,和多個省市的政策的先一步推進,不少二類甚至一類醫療器械企業開始著手準備醫療器械唯一標識(UDI)的實施工作。但由于缺少相關經驗,加之政策法規細則較多,大多數醫療器械企業反映在學習或者實施難度都比較大。那么,到底該如何申請UDI呢?我們為大家整理了一份UDI申請操作指南,以供大家參考:
步驟一:確定UDI實施的產品范圍、注冊人/備案人
UDI 實施范圍見 2019 年《國家藥監局關于做好第一批實施醫療器械唯一標識工作有關事項的通告》、2020 年《國家藥監局 國家衛生健康委 國家醫保局關于深入推進試點做好第一批實施醫療器械唯一標識工作的公告》、2021 年《國家藥監局 國家衛生健康委 國家醫保局關于做好第二批實施醫療器械唯一標識工作的公告》,2023年以及國家藥監局的相關文件要求。
“醫療器械注冊人 / 備案人,是指取得醫療器械注冊證或者辦理醫療器械備案的企業或者研制機構”——《醫療器械監督管理條例》(中華人民共和國國務院令第 739 號)。
步驟二:申請廠商識別代碼
首先,企業需要申請成為GS1系統成員,也就是申請UDI-DI廠商識別代碼。申請方式分為線上及線下兩種。線上主要是通過登錄中國物品編碼中心網站進行申請;線下可以攜帶企業法人營業執照或營業執照副本及復印件,前往企業注冊所在地編碼分支機構窗口辦理。
步驟三:分配產品標識
為醫療器械最小銷售單元和更高級別的包裝或者醫療器械產品分配 GTIN。當最小銷售單元中使用單元的數量大于 1 時,應同時為使用單元分配 GTIN。確保 GTIN 在數據庫中存儲為 14 位,若使用 GTIN-13 應在前面補“0”。
物流包裝如需編碼可使用系列貨運包裝箱代碼(SSCC),詳見《商品條碼 物流單元編碼與條碼表示》(GB/T 18127 — 2009)。
步驟四:分配生產標識
根據監管和實際應用需求,確定生產標識是否包含醫療器械序列號、生產批號、生產日期、失效日期等。器械種類不同,生產標識可能不同。
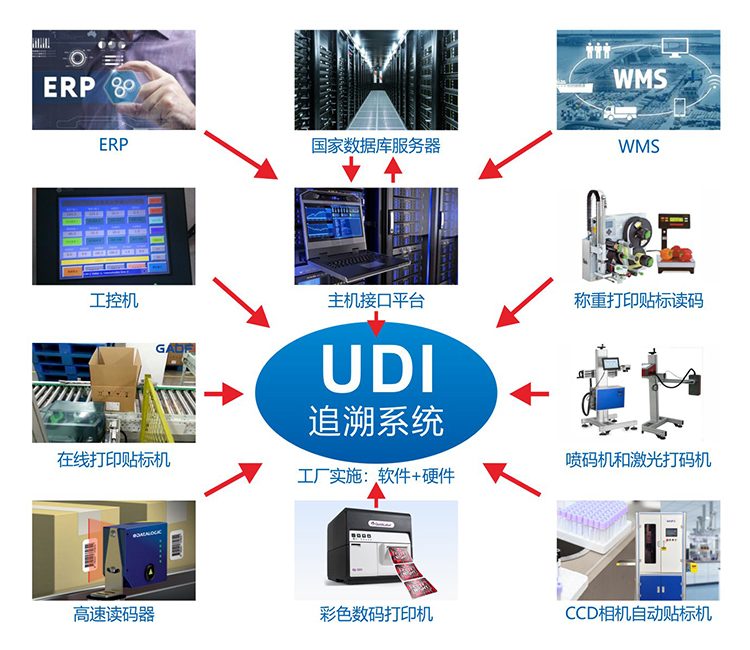
步驟五:UDI標簽打印與檢測
企業可以登錄UDI服務平臺進行UDI標簽制作,平臺為企業提供多種規格的標簽樣式模板及個性化標簽設計制作功能。制作結束后,企業需要將UDI唯一編碼通過打印設備完成打印并附在產品包裝上。需要注意的是,不同的賦碼設備,包裝不同,操作模式也不同,企業需要根據自己的產品進行賦碼設備的選擇,比如目前主流可以滿足醫療器械行業的需求的打印機有:臺式熱轉印打印機、在線熱轉印TTO、UV噴碼機、激光打印機、熱發泡噴碼機。
同時,根據相關法規、標準、《GS1 通用規范》以及《GS1 醫療 AIDC 實施指南》等確定條碼印制質量、人工識讀內容和載體放置位置等細節,對條碼、RFID 標簽質量進行檢測。
步驟六:提交 UDI 數據
申請首次注冊、延續注冊或者注冊變更時,注冊申請人 / 注冊人應當在國家藥品監督管理局注冊管理系統中提交其最小銷售單元的產品標識。
上市銷售前,注冊人應當按照相關標準或者規范要求將最小銷售單元、更高級別包裝的產品標識和相關數據上傳至國家藥監局醫療器械唯一標識數據庫。
步驟七:關聯醫保數據
對于已在國家醫保局醫保醫用耗材分類與代碼數據庫中維護信息的醫療器械,要在唯一標識數據庫中補充完善醫保醫用耗材分類與代碼字段,同時在醫保醫用耗材分類與代碼數據庫維護中完善醫療器械唯一標識相關信息,并確認與醫療器械唯一標識數據庫數據的一致性。
步驟八:維護數據
當醫療器械最小銷售單元產品標識相關數據發生變化時,注冊人 / 備案人應當在產品上市銷售前,在醫療器械唯一標識數據庫中進行變更,實現數據更新。
醫療器械最小銷售單元產品標識變化時,應當按照新增產品標識在醫療器械唯一標識數據庫上傳數據。



